Konstanta
gas (disebut juga konstanta gas
ideal, molar, semesta, atau universal, biasanya dilambangkan dengan huruf R) adalah sebuah konstanta fisika yang
sering muncul dalam banyak persamaan fundamental fisika, seperti hukum gas
ideal dan persamaan Nernst.
Konstanta ini ekuivalen dengan konstanta Boltzmann, tetapi dinyatakan dalam
satuan energi
per kelvin
per mol
(daripada energi per kelvin per partikel).
Harganya adalah:
R = 8.314472(15) J · K-1
· mol-1
Dua digit di dalam kurung adalah ketidakpastian (deviasi
standar) pada harga dua digit terakhir.
Konstanta gas didapatkan dari persamaan keadaan
paling sederhana, hukum gas ideal, sebagai berikut:
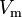 adalah volume molar
adalah volume molar|
Harga R
|
Satuan
(V·P·T-1·n-1) |
|
8.314472
|
J·K-1·mol-1
|
|
0.0820574587
|
|
|
83.14472
|
|
|
8.20574587 × 10-5
|
m3·atm·K-1·mol-1
|
|
8.314472
|
cm3·MPa·K-1·mol-1
|
|
8.314472
|
L·kPa·K-1·mol-1
|
|
8.314472
|
m3·Pa·K-1·mol-1
|
|
62.36367
|
L·mmHg·K-1·mol-1
|
|
62.36367
|
L·Torr·K-1·mol-1
|
|
83.14472
|
L·mbar·K-1·mol-1
|
|
0.08314472
|
L·bar·K-1·mol-1
|
|
1.987
|
kal·K-1·mol-1
|
|
6.132440
|
lbf·ft·K-1·mol-1
|
|
10.73159
|
|
|
0.7302413
|
ft3·atm·°R-1·lb-mol-1
|
|
998.9701
|
ft3·mmHg·K-1·lb-mol-1
|
|
8.314472 × 107
|
erg·K-1·mol-1
|
|
1716 (Hanya Udara)
|
ft·lb·°R-1·slug-1
|
|
286.9 (Hanya Udara)
|
N·m·kg-1·K-1
|
|
286.9 (Hanya Udara)
|
J·kg-1·K-1
|
Hubungan dengan konstanta Boltzmann
Konstanta Boltzmann kB
(kadang disingkat k) dapat digunakan sebagai konstanta gas ideal dengan
menghitung jumlah partikel, N, daripada jumlah substansi, n,
dengan:
dengan NA adalah konstanta Avogadro. Sebagai contoh, hukum gas
ideal dengan menggunakan konstanta Boltzmann adalah
dengan N adalah jumlah partikel/molekul.

0 komentar:
Posting Komentar